中國國家藥監(jiān)局藥品審評中心(CDE)最新公示,安若維他藥業(yè)泰州有限公司(下稱安若維他藥業(yè))在中國申報抗HIV藥物硫酸阿扎那韋膠囊的5.2類藥品上市申請獲得了受理���。值得一提的是�,目前中國僅有百時美施貴寶(BMS)一家公司的阿扎那韋在中國上市����,該藥自2005年獲批以來����,中國化合物專利已于2017年到期�,但至今尚未有其他公司提出同類產(chǎn)品的臨床試驗或上市申請。此次安若維他藥業(yè)在中國申報阿扎那韋的上市申請��,將有望為中國HIV感染患者帶來新的治療選擇�����。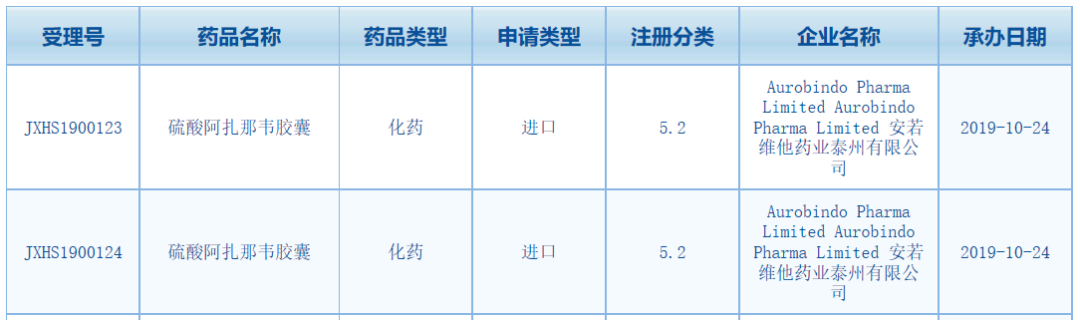
▲截圖來源:CDE官網(wǎng)
人類免疫缺陷病毒(HIV)�,即艾滋?���。ˋIDS,獲得性免疫缺陷綜合征)病毒�����,是造成人類免疫系統(tǒng)缺陷的一種病毒�。它把人體免疫系統(tǒng)中最重要的CD4T淋巴細(xì)胞作為主要攻擊目標(biāo),大量破壞該細(xì)胞�����,使人體喪失免疫功能。聯(lián)合國艾滋病規(guī)劃署最新發(fā)布的《全球艾滋病最新情況——以社區(qū)為中心》報告顯示����,2018年估計全球艾滋病病毒感染者3790萬人。其中�,仍然有47%的艾滋病感染者沒有得到有效的治療。目前中國已上市26款抗艾滋病藥物及多個復(fù)方制劑���。其中有8款產(chǎn)品在中國尚未有同類產(chǎn)品獲批上市�,包括BMS的阿扎那韋����。硫酸阿扎那韋(Atazanavir Sulfate)是BMS旗下一款HIV-1蛋白酶抑制劑,與其他抗逆轉(zhuǎn)錄病毒藥物一樣����,它用于治療HIV感染的患者。作為HIV-1蛋白酶的高選擇性和高效抑制劑��,阿扎那韋通過選擇性抑制HIV-1感染細(xì)胞中病毒Gag和Gag-Pol多聚蛋白的特定加工過程�����,從而阻斷成熟病毒體的形成�����。
2003年6月,美國FDA批準(zhǔn)了阿扎那韋膠囊上市��,該藥成為美國首個獲批用于每日一次給藥的蛋白酶抑制劑�。2014年6月,該藥口服散劑的新劑型在美國獲批上市�,用于與其他抗逆轉(zhuǎn)錄病毒藥物聯(lián)用,治療3個月以上�、體重至少10kg的1型人類免疫缺陷病毒(HIV-1)感染患者。
由于阿扎那韋具有每日僅服用1次��,比其他抗HIV病毒感染藥物吸收迅速�、不良反應(yīng)少等優(yōu)勢��,同時與其它蛋白酶抑制劑相比在服藥期間不干擾正常的飲食����。阿扎那韋在全球上市后得到了醫(yī)生和患者的廣泛認(rèn)可。數(shù)據(jù)顯示�����,2007年其全球銷售額已超過10億美元�,可謂是重磅炸彈級產(chǎn)品���。在中國,這款艾滋病新藥早在2005年就以商品名銳艾妥獲得中國國家藥監(jiān)局批準(zhǔn)上市����,用于與其他抗逆轉(zhuǎn)錄病毒藥物聯(lián)合使用治療HIV-1感染。不過����,BMS的阿扎那韋從獲批至今,尚未在中國迎來第二款同類產(chǎn)品���。查詢藥物臨床試驗登記與信息公示平臺����,也尚未有同類產(chǎn)品開展臨床試驗��。在去年底CDE公布的《第二批專利權(quán)到期�、終止、無效且尚無仿制申請的藥品清單》里�����,硫酸阿扎那韋被列入其中。清單顯示�����,該藥的中國化合物專利已于2017年4月14日到期��。清單的公布意在引導(dǎo)仿制藥研發(fā)生產(chǎn)����,提高公眾用藥可及性。此次安若維他藥業(yè)在中國申報阿扎那韋的上市申請�,也意味著這款獨家品種,在中國終于將迎來第二款同類產(chǎn)品����。
值得一提的是,此次申請阿扎那韋的安若維他藥業(yè)���,是由安若維他印度總部在泰州投資1億美元成立的公司���。據(jù)悉�,安若維他印度總部是一家大型跨國公司,為印度第二大制藥上市公司�����,其僅在2017年就有350個美國仿制藥申請獲批。
2018年7月�,安若維他藥業(yè)泰州項目開工儀式在中國醫(yī)藥城舉行。根據(jù)公告��,這一項目的用地面積約97畝���,建成全部達(dá)產(chǎn)后��,年生產(chǎn)片劑35億片��,年產(chǎn)膠囊劑5億粒���。工廠按中國GMP、歐盟GMP及美國cGMP標(biāo)準(zhǔn)建設(shè)�����,投產(chǎn)后產(chǎn)品將銷往歐美發(fā)達(dá)國家及中國市場���,年銷售將突破20億元�����。
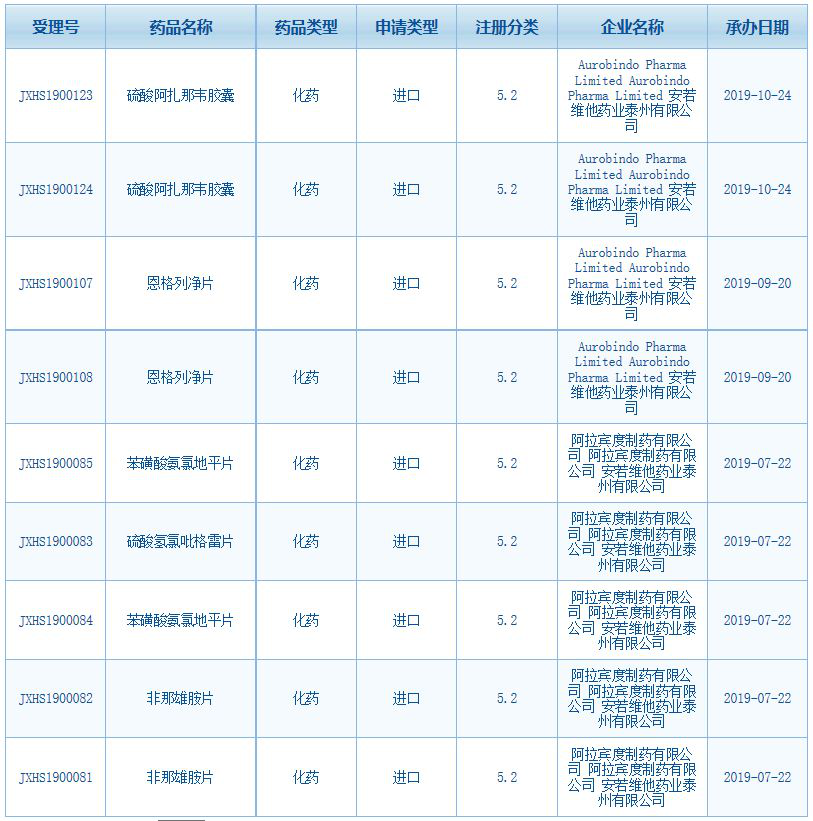
▲截圖來源:CDE官網(wǎng)
今年下半年以來����,安若維他藥業(yè)陸續(xù)在中國提交藥品上市申請。CDE官網(wǎng)數(shù)據(jù)顯示����,阿扎那韋是安若維他藥業(yè)在中國申報上市的第五款產(chǎn)品。此前�����,該公司已申報了非那雄胺片���、苯磺酸氨氯地平片����、硫酸氫氯吡格雷片�、恩格列凈片等四款產(chǎn)品的上市申請。這些產(chǎn)品均為按照5.2類申請進(jìn)口的品種��。這也意味著����,安若維他藥業(yè)正在加速將其更多產(chǎn)品帶到中國,從而惠及需要的患者�。





